ORALES ANTIDIABETIKUM VILDAGLIPTIN (GALVUS, IN EUCREAS)
Mit mehrmonatiger Verzögerung kommt jetzt nach Sitagliptin (JANUVIA; a-t 2007; 38: 56-7) der zweite Hemmstoff der Dipeptidylpeptidase (DPP)-4 Vildagliptin als Monopräparat (GALVUS) und als Fixkombination mit Metformin (EUCREAS) zur Behandlung des Typ-2-Diabetes in den Handel. Die Zulassung ist beschränkt auf die Kombination mit Metformin (GLUCOPHAGE, Generika), einem Sulfonylharnstoff (falls Metformin ungeeignet ist) oder einem Glitazon, wenn die jeweilige Monotherapie nicht ausreichend wirkt.1,2 Die Markteinführung verlief stockend. Die EMEA erteilte im September 2007 die Zulassung unter anderem für eine einmal tägliche Dosierung von 100 mg bei Kombination mit Metformin oder einem Glitazon.1 Weil in einer Analyse eine erhöhte Inzidenz hepatischer Störwirkungen errechnet wurde, ist die 100-mg-Dosis fallen gelassen worden. Zugelassen ist jetzt nur noch die ein- bis zweimal tägliche Einzeldosierung zu 50 mg.3 Allerdings treten auch unter zweimal täglich 50 mg Leberschädigungen auf. Bereits während des Zulassungsprozesses war Sand im Getriebe: Die Anträge auf Zulassung zur Monotherapie (bei Nichtverträglichkeit von Metformin) sowie für die Kombinationsbehandlung mit Insulin wurden aufgrund von Bedenken der europäischen Zulassungsbehörde vom Hersteller zurückgezogen.1
EIGENSCHAFTEN:Durch Hemmung von DPP-4 kommt es zu einem Anstieg der Inkretinhormone Glucagon-like Peptid (GLP) 1 und Glucose-dependent Insulinotropic Peptid (GIP). Dadurch steigt die glukoseabhängige Insulinsekretion der Betazellen des Pankreas. Die Pharmakokinetik von Vildagliptin ähnelt der von Sitagliptin.

KLINISCHE WIRKSAMKEIT: Im europäischen Bewertungsbericht1 werden acht klinische Studien berücksichtigt. Bis auf eine einjährige Untersuchung - bei der jedoch die nicht zugelassene Monotherapie geprüft wird - verlaufen alle über 24 Wochen. Die nunmehr zugelassene Indikation als "add-on" wird in drei Studien geprüft.4-6 In ihnen sinken die HbA1c-Werte gegenüber Plazebo unter täglich 50 mg um 0,5% bis 0,8%, bei Tagesdosierungen von 100 mg um 0,7% bis 1,1%. Wie bei Sitagliptin erscheint die Wirkung von Vildagliptin im Vergleich mit anderen Antidiabetika schwächer (übliche HbA1c-Senkung unter Metformin oder Sulfonylharnstoffen 1% bis 1,5%): Der Versuch, eine Nichtunterlegenheit nachzuweisen, misslingt sowohl im Vergleich mit Metformin7 als auch mit Rosiglitazon (AVANDIA).*8 Die zulassungsrelevanten Studien sind lückenhaft publiziert (z.B. keine Beschreibung der Randomisierung). Zudem gab es offenbar technische Probleme mit den Blutzuckermessungen in sechs Phase-III-Studien, sodass wegen unzuverlässiger Messwerte Reanalysen durchgeführt und Patienten nachrekrutiert werden mussten.1 Wie üblich bei neuen Antidiabetika fehlen zum Zeitpunkt der Zulassung Daten zum Einfluss auf diabetische Spätkomplikationen (a-t 2007; 38: 79-80).
SICHERHEIT: Hypoglykämien treten unter Vildagliptin bei 1,4% der Patienten auf. Schwere Hypoglykämien kommen laut Bewertungsbericht der EMEA nicht vor. Wegen potenzieller Leberschädlichkeit sind die Leberwerte regelmäßig zu kontrollieren. Harnwegsinfekte treten in einer Studie deutlich häufiger als unter Plazebo auf (3,6% versus 1,3%).9 Da DPP-4 eine Rolle bei der Funktion weißer Blutzellen spielt, ist dies ein Risikosignal.9 Wie unter Sitagliptin kommt es in Kombination mit Pioglitazon (ACTOS) zu einer Zunahme von Ödemen (7% vs. 2,5% unter Pioglitazon allein). Dies kann auf eine Steigerung des kardiovaskulären Schädigungspotenzials des Glitazons hinweisen. Vildagliptin darf bei Herzinsuffizienz (NYHA III-IV) nicht eingenommen werden. Das Körpergewicht steigt unter täglich 100 mg Vildagliptin stärker als unter Plazebo (2,7 kg vs. 1,4 kg). Vereinzelt sind Angioödeme aufgetreten, offenbar besonders bei gleichzeitiger Einnahme eines ACE-Hemmers.1
Die Bedeutung einer Zunahme von Hämangiosarkomen bei männlichen Mäusen unter hohen Dosierungen ist unklar. Bei Hunden sind unter hohen Dosierungen zudem plötzliche Todesfälle aufgrund von Herzrhythmusstörungen aufgetreten. In den klinischen Studien sind zwar keine Rhythmusstörungen auffällig geworden. Es wird jedoch eine erhöhte Inzidenz von AV-Block Grad I unter Vildagliptin beobachtet.1
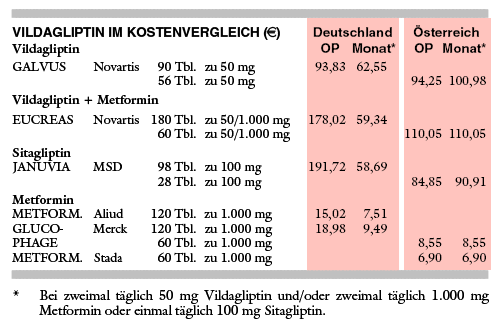
KOSTEN: Für die Verordnung von zweimal täglich 50 mg Vildagliptin (GALVUS 63 €/Monat) sind 7% mehr aufzubringen als für den ohnehin schon teuren Konkurrenten Sitagliptin (JANUVIA, 59 €/Monat, 1 x tgl. 100 mg). Die Fixkombination EUCREAS (2 x tgl. 50 mg Vildagliptin plus 1.000 mg Metformin) kostet mit 59 € pro Monat sogar weniger als Vildagliptin allein. Dies veranschaulicht die Beliebigkeit der Preis-"Kalkulation".
Der neue blutzuckersenkende Dipeptidylpeptidase (DPP)-4-Hemmer Vildagliptin (GALVUS) ist ausschließlich zur Kombination mit Metformin (GLUCOPHAGE, Generika; Fixkombination EUCREAS), einem Sulfonylharnstoff wie Glibenclamid (EUGLUCON N, Generika) oder einem Glitazon wie Pioglitazon (ACTOS) zugelassen. Mit der Kombination wird eine zusätzliche Senkung des HbA1c um 0,5% bis 1,1% gegenüber Plazebo erreicht.
Aufgrund hepatischer Störwirkungen darf die Tagesdosis von 100 mg Vildagliptin nicht - wie zunächst vorgesehen - auf einmal eingenommen werden. Die Dosis muss auf zweimal 50 mg verteilt werden. Allerdings kommt es offensichtlich auch bei aufgeteilter Dosis zu Schadwirkungen an der Leber.
Harnwegsinfekte treten in einer Studie gehäuft auf. In Kombination mit einem Glitazon entwickeln sich häufig Ödeme, möglicherweise ein Hinweis auf eine Verstärkung der kardiovaskulären Toxizität des Glitazons.
Die vorliegenden Daten mögen für eine Zulassung genügen, reichen aber für eine therapeutische Empfehlung wegen fehlender Langzeitdaten zu klinischer Wirksamkeit und Sicherheit nicht aus. Wir sehen keinen Stellenwert für das neue Antidiabetikum.
| (R = randomisierte Studie, M = Metaanalyse) | ||
| 1 | EMEA: Europ. Beurteilungsbericht (EPAR) GALVUS, Stand Febr. 2007, zu finden unter http://www.emea.europa.eu/htms/human/epar/g.htm | |
| 2 | Novartis: Fachinformation GALVUS, Stand März 2008 | |
| 3 | EMEA: GALVUS; Procedural steps taken and scientific information after the authorisation; Information vom 13. Dez. 2007 | |
| R | 4 | GARBER, A.J. et al.: Diabetes Obes. Metab. 2007; 9: 166-74 |
| R | 5 | GARBER, A.J. et al.: Diabetes Obes. Metab. 2008; epub vom 18. Febr. 2008 |
| R | 6 | BOSI, E. et al.: Diabetes Care 2007; 30: 890-5 |
| R | 7 | SCHWEIZER, A. et al.: Diabet. Med. 2007; 24: 955-61 |
| R | 8 | ROSENSTOCK, J. et al.: Diabetes Care 2007; 30: 217-23 |
| M | 9 | AMORI, R.E. et al.: JAMA 2007; 298: 194-206 |
| * | In der Studie8 wird zwar eine Nichtunterlegenheit gegenüber Rosiglitazon behauptet. Diese lässt sich allerdings nur bei Analyse der "Intention-to-treat"-Population berechnen. Bei der für Nichtunterlegenheitsanalysen relevanten "Per-Protocol"-Analyse misslingt der Nachweis.1 |
© 2008 arznei-telegramm, publiziert am 6. Juni 2008
Autor: Redaktion arznei-telegramm - Wer wir sind und wie wir arbeiten
Diese Publikation ist urheberrechtlich geschützt. Vervielfältigung sowie Einspeicherung und Verarbeitung in elektronischen Systemen ist nur mit Genehmigung des arznei-telegramm® gestattet.
